Suda çözündüğünde OH– iyonu veren maddelere baz adı verilir .
Bazların özellikleri
1- Kırmızı turnusol kağıdını maviye çevirir
2 – Tatları acıdır ( Sabun gibi )
3 – Metallere etki etmez ancak amfoter metallerle ( Zn, Al ) kuvvetli asitler etki eder
4 – Sulu çözeltileri elektrik akımını iletir
5 – Ele kayganlık hissi verir
6 – Asitlerle tepkimeye girerek tuz ve su oluşturur
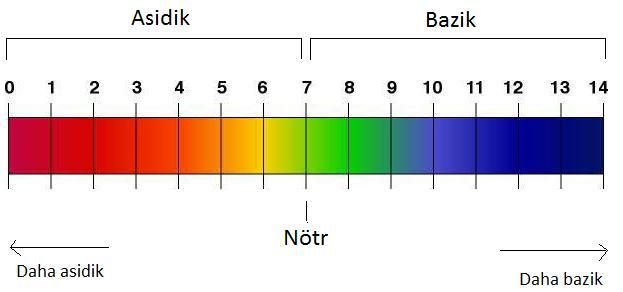
7 – pH değerleri 7 den büyüktür
8 – Sulu çözeltilerin de OH– iyonu oluşturur
9 – Cam ve porseleni aşındırır
NOT
Bazı bileşikler yapılarında OH– iyonu içermesine rağmen baz değildir .
CH3COOH baz değil asittir
Bazı bileşiklerin yapısında OH– iyonu içermemesine rağmen bazdır .
NH3 baz özellik gösterir.
Önemli Bazlar
NaOH ===> Na+ + OH– ===> Sodyum hidroksit
KOH ===> K+ + OH– ===> Potasyum hidroksit
Mg(OH)2 ===> Mg+2 + 2OH– ===> Magnezyum hidroksit
Ca(OH)2 ===> Ca+2 + 2OH– ===> Kalsiyum hidroksit
NH3 + H2O ===> NH4+ + OH– ===> Amonyak